原子结构与元素性质 · 二 · 「构造原理、泡利原理、洪特规则」
原子轨道
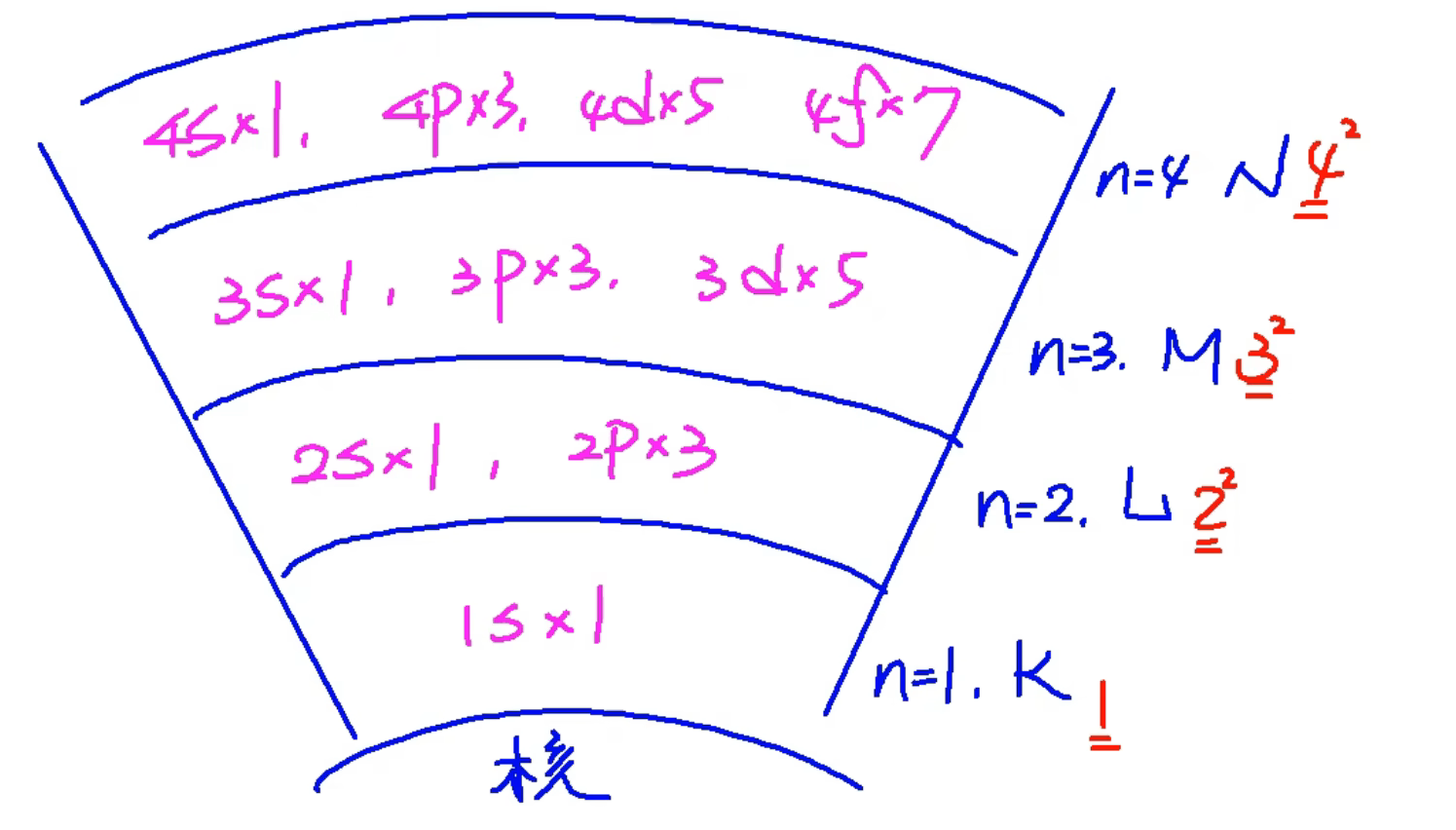
对每个
有
种能级; 有
个原子轨道; 最多可容纳
个 ;
构造原理
构造原理(aufbau principle):从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。

顺序 :
我们把第三个不等式中涉及到的能级组成的集合称为能级组。
| 能级组序号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
|---|---|---|---|---|---|---|---|
| 能级 | |||||||
| 最大电子容纳量 |
泡利不相容原理
泡利原理:在一个原子轨道里,最多只能容纳 2 个电子,它们的自旋 相反,常用上下箭头(
的轨道表示式如下:
简并轨道:能量 相同的原子轨道
电子对:同一个原子轨道中,自旋方向 相反 的一对电子
单电子:一个原子轨道中若只有一个电子,则该电子称为单电子
自旋平行:箭头同向 的单电子称为自旋平行
在氧原子中,有 3 对电子对,有 2 个单电子
在氧原子中,有 5 种 空间运动状态,有 8 种 运动状态不同 的电子
洪特规则
内容:基态原子中,填入 简并轨道 的电子总是先单独分占,且自旋平行
特例:在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有 较低 的能量和 较大 的稳定性
的电子排布式为 ,为半充满状态,易错写为 。
的电子排布式为 ,为全充满状态,易错写为
基态原子:处于 最低能量 状态的原子。
激发态原子:基态原子 吸收能量,它的电子会跃迁到 较高能级,变成 激发态原子。
能量最低原理
内容:在构建基态原子时,电子将尽可能地占据 能量最低 的原子轨道,使整个原子的能量最 低。
因素:整个原子的能量由 核电荷数 、 电子数 和 电子状态 三个因素共同决定。
原子光谱
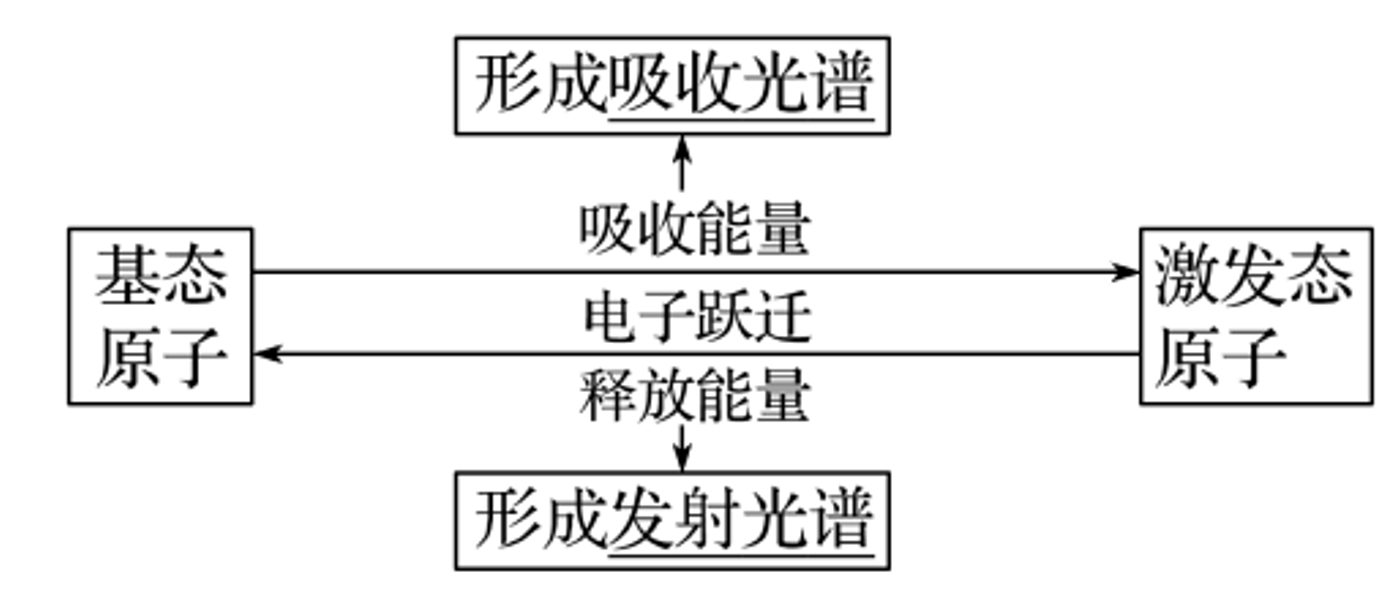
焰色反应
物理反应,进行焰色反应应使用 铂丝(镍丝、无锈铁丝)。把嵌在玻璃棒上的金属丝在 稀盐酸 里蘸洗后,放在酒精灯的火焰里灼烧,不同金属元素会使火焰变为各种颜色,这便是焰色反应。焰色反应的形成与原子光谱有关
光谱分析
在现代化学中,常利用原子光谱上的 特征谱线 来鉴定元素,称为光谱分析。