分子空间结构与物质性质 · 二 · 「杂化理论体系」
甲烷分子中,
的价电子是 , 原子的 个价层原子轨道是 个相互垂直的 和 个球形的 ; 的价电子是 按照我们已经学过的价键理论,甲烷的
个 单键都应该是 键,然而,碳原子的 个价层原子轨道是 个相互垂直的 轨道和 个球形的 轨道,用它们跟 个氢原子的 原子轨道重叠,不可能得到正四面体构型的甲烷分子 为了解决这一矛盾,鲍林提出了杂化轨道理论
杂化轨道:在外界条件的影响下,原子内部能量相近的原子轨道重新组合为一组新的原子轨道,称为杂化轨道
杂化目的:原子轨道的电子云一头大一头小,成键时利用大的一头可以使电子云重叠程度更大,从而形成稳定的化学键。即杂化轨道增强的成键能力
杂化轨道分类:
杂化:由 个 轨道和 个 轨道杂化而成,杂化轨道间夹角为 ,呈正四面体形 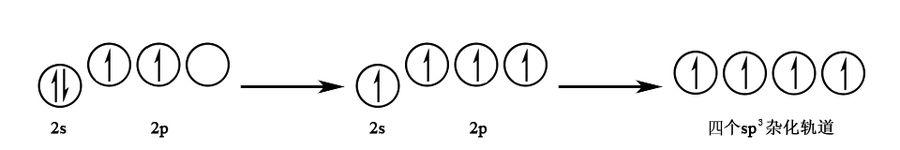
杂化:由 个 轨道和 个 轨道杂化而成,杂化轨道间夹角为 ,呈平面三角形 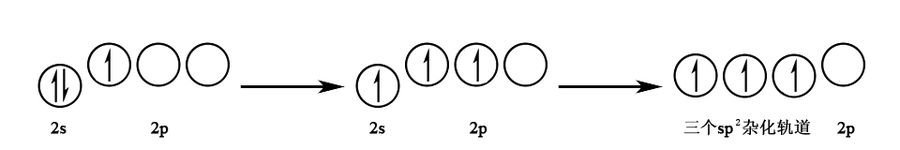
杂化:由 个 轨道和 个 轨道杂化而成,杂化轨道间夹角为 ,呈直线形 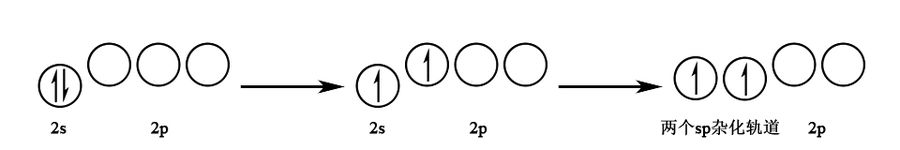
中心原子对杂化的影响
当中心原子的杂化方式确定后,杂化轨道上的电子对就可以确定,从而分子的空间构型也就可以确定。但是,中心原子的孤电子对对杂化方式和分子构型也有影响。
孤电子对的排斥作用:孤电子对的排斥作用比成键电子对的排斥作用大,因此孤电子对的存在会使分子的空间构型发生改变
孤电子对的杂化:中心原子的孤电子对也可以参与杂化,从而影响分子的空间构型
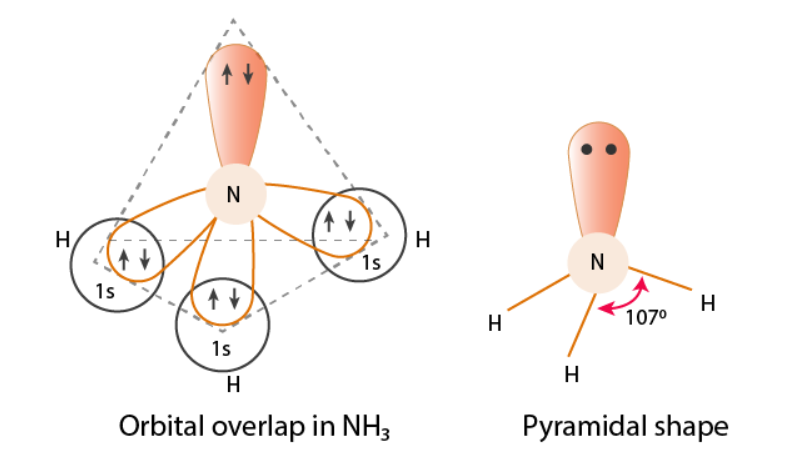
中心原子杂化类型和分子构型的相互判断
| 分子组成 | 中心原子的孤电子对 | 中心原子的杂化方式 | 分子空间构型 | 实例 |
|---|---|---|---|---|
| 直线形 | ||||
| 平面三角形 | ||||
| 三角锥形 | ||||
| 四面体形 |
大
定义
在多原子分子或离子中如有 相互平行的
轨道,它们连贯重叠在一起构成一个整体, 电子在多个原子间运动形成 型化学键,这种不局限在两个原子之间的 键称为 离域 键,或共轭大 键,简称大 键 条件
所有原子在同一平面,中心原子采取
杂化 或 杂化 表示方法:
其中,
指参与形成大 键的原子数, 指参与形成大 键的电子数
判断大
常规判断方式
观察给出的结构简式或画出结构简式
判断各原子的杂化方式(一般为
杂化,有 个杂化轨道) 画出杂化轨道形成的
键,未形成 键的孤电子对用「 」表示
画出各原子剩余的价电子,它们存在于未杂化的
轨道内,“肩并肩”重叠形成大 键
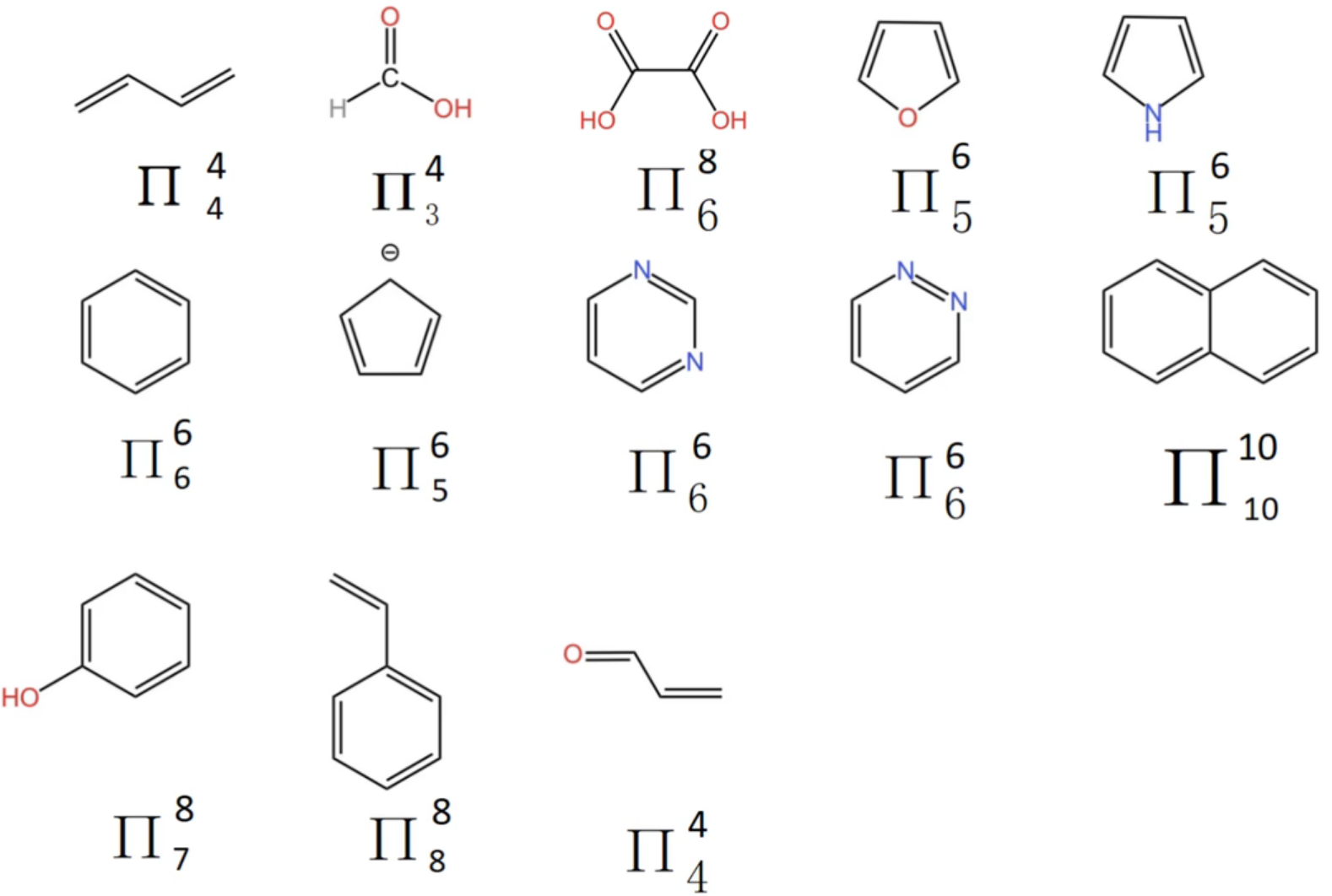
吡啶
的结构分析:
原子和 原子均为 杂化,分子空间结构为平面形 对
原子分析:
原子最外层有 个价电子
个杂化轨道中: 个用于形成 键, 个用于形成孤电子对 还剩下
个价电子放在未杂化的 轨道内用以形成大 键 对
原子分析:
原子最外层有 个价电子
个杂化轨道中:全部 个用于形成 键 还剩下
个价电子放在未杂化的 轨道内用以形成大 键 总计以上在未杂化的
轨道内的价电子一共 个,参与原子 个 所以,大
键类型为:
咪唑
的结构分析:
原子和 原子均为 杂化,分子空间结构为平面形 对
原子分析:
原子最外层有 个价电子
个杂化轨道中: 个用于形成 键 还剩下
个价电子放在未杂化的 轨道内用以形成大 键 对
原子分析:
原子最外层有 个价电子
个杂化轨道中: 个用于形成 键, 个用于形成孤电子对 还剩下
个价电子放在未杂化的 轨道内用以形成大 键 对
原子分析:
原子最外层有 个价电子
个杂化轨道中:全部 个用于形成 键 还剩下
个价电子放在未杂化的 轨道内用以形成大 键 总计以上在未杂化的
轨道内的价电子一共 个,参与原子 个 所以,大
键类型为:
规律判断
对高中常见含有 大
键 的分子或离子 三原子分子:
四原子分子:
考试中可以直接使用三原子即为
,四原子即为 ,仅有例外: 能画出结构式的有机物
数出 不饱和键(双键和三键看成等价)、负电荷、孤对电子
要求:
每个原子只能数一次(一个原子不能数了两次负电荷或两对孤对电子)
每个原子只能数一种东西(每个原子数了不饱和键就不能数负电荷,数了负电荷就不能数孤对电子)
数一次记两个电子
等电子理论
等电子体与等电子原理
原子总数相等且价电子总数相等的微粒互为等电子体,等电子体中心原子的杂化轨道类型相同,具有相同的空可结构和相同的化学键类型等结构特征,物理性质相近,但化学性质差别较大
等电子体的确定方法
同族元素互换法:即将既定粒子中的某元素换成它的同族元素
价电子迁移法:即将既定粒子中的某元素原子的价电子逐一转移给粒子中的另一种元素的原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素
电子电荷互换法:即将既定粒子中的某元素原子的价电子转化为粒子所带的电荷,相应原子的质子数也随之减少或增加。这种方法可实现分子与离子的互换
常见等电子体
$5A-8e^{-}:\ce{CH_{4} },\ce{NH_4^{+} }, S i H _ { 4 } , P H _ 4 ^ { + } , B H _ 4 ^ { - } $
$2 A - 1 0 e ^ { - } : N _ { 2 } , C O , C N ^ { - } , C _ 2 ^ { 2 - } $
$3 A - 1 6 e ^ { - } : C O _ { 2 } , C S _ { 2 } , B e C l _ { 2 } , N _ { 2 } O , S C N ^ { - } , C N O ^ { - } , N _ 3 ^ { - } $
等电子原理的应用
利用等电子原理可以判断一些陌生分子或离子的空间结构、成键情况,及其对应物质的某些性质,如
与 互为等电子体,二者同为直线形分子; 与 互为等电子体,二者分子结构中均存在共价三键等 利用等电子体可以制造新材料,如晶体硅、锗是良好的半导体材料,其等电子体
也是良好的半导体材料
简介
有些元素原子在形成化合物时,除了
轨道发生杂化外,其同一能层能量相近的 轨道也参与杂化。常见的杂化方式有 等,通常存在于过渡元素形成的化合物中 判断方法
先计算出中心原子的价层电子对数,若大于
,一般有 轨道参与杂化,并有相应的空间结构模型: 价层电子对数 杂化类型 模型 平面四边形 三角双锥形 正八面体形 五角双锥形 不是所有的元素原子均能发生
轨道参与的杂化,例如,由于第二周期元素原子的第二能层不存在 轨道, 与 只能通过 杂化形成 ;而 与 既可以通过 杂化形成 $ PCl_3$,也可以通过 杂化形成