元素及其化合物 · 八 · 「硫
游离态:硫单质俗称硫黄,主要存在于火山口附近或地壳的岩层中
化合态:主要以 硫化物 和 硫酸盐 的形式存在
黄铁矿 黄铜矿 石膏 芒硝 的常见化合价: (无 价)
硫单质
物理性质
色态:黄色晶体,质脆,易研成粉末
溶解性:难溶于水,微溶于酒精,易溶于二硫化碳
,易溶于热煤油(化工题常考) 因此二硫化碳可用于洗涤内壁附着硫单质的试管
化学性质
硫单质既表现 氧化性 ,又表现 还原性
与
反应: 硫化氢,
,臭鸡蛋味,有毒 与
反应: 无论氧气是否过量,产物均为二氧化硫(三氧化硫只在特殊的催化条件下生成)。发出明亮的蓝紫色火焰
与金属反应
的氧化性比 弱,只能生成金属的低价态; 用于覆盖实验室撒落的汞以处理汞。
硫酸
物理性质
纯硫酸是无色、黏稠的油状液体,沸点高、难挥发。常用的浓硫酸的质量分数是
化学性质
难挥发性:用于制备挥发性酸(如
) 强酸性
制磷酸:
> 一般使用 $70\%$ 的浓硫酸,因为 $98\%$ 的浓硫酸氢离子浓度过小吸水性
浓硫酸具有 强烈的吸水能力 ,能 吸收空气中的水分 ,甚至能 吸收结晶水合物的水 ,故浓硫酸常用作 干燥剂 ,干燥一些 不与浓硫酸反应的气体 。
用浓
可干燥 等气体,但不能干燥 等气体 运用:在乙酸乙酯的制备实验中,用浓硫酸吸水,促进反应正向移动,提高乙酸乙酯的产率
脱水性
浓硫酸具有很强的腐蚀性,能按氢、氧原子
的比例脱去纸、棉布、木条等有机物中的氢、氧元素;浓硫酸具有强腐蚀性与脱水性有很大关系,如浓硫酸会使蓝色石蕊试纸先变红,后变黑(碳化) - 蔗糖的脱水实验:
既体现浓硫酸的 脱水性 又体现 强氧化性
- 醇的消去反应:
- 蔗糖的脱水实验:
强氧化性
硫酸中的硫元素处于最高价态。浓硫酸 能与许多物质发生氧化还原反应,是常见的氧化剂
与铜反应:
不浓不热不反应
与木炭反应:
其他
- 在常温下,浓
与 反应,生成了致密、坚固的氧化膜阻止金属与浓 接触,从而保护了金属。因此常温下可用 制容器盛放浓 ;浓 与 可以反应,浓 与 常温下不反应 - 金属单质或低价金属的盐与浓
反应时,浓 既显氧化性又显酸性(与铜反应
- 在常温下,浓
二氧化硫
物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(1 体积的水能溶解约 40 体积的二氧化硫),可用于杀菌消毒(向葡萄酒中加入适量二氧化硫)
化学性质
Ⅰ
与水反应:
为二元酸; 为中强酸, 电离大于水解,因此 显酸性( 同理) 与碱反应:
- 少量
通入 溶液: - 过量
通入 溶液:
- 少量
制备:
Ⅱ
还原性
二氧化硫在适当的温度并有催化剂存在的条件下,可以被氧气氧化,生成三氧化硫
三氧化硫也是一种酸性氧化物,溶于水时与水发生剧烈反应,生成硫酸
应用:工业制备硫酸(接触法制硫酸)
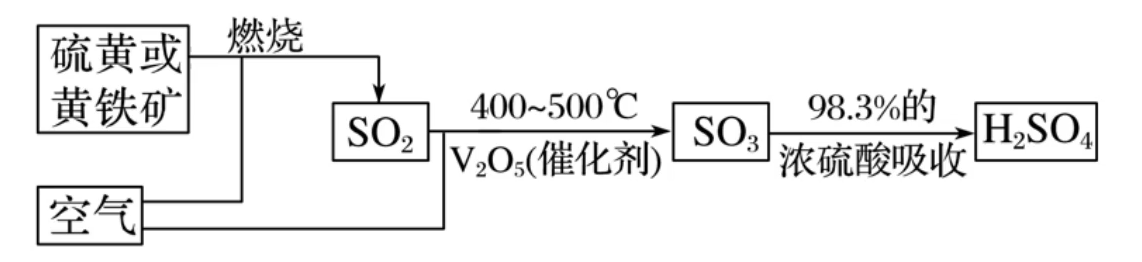
工业上一般以硫磺(
)或其它含疏物(如黄铁矿 )为原料来制备硫酸。金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸 或 (一般工业上不用水吸收三氧化硫,而是使用二氧化硫,因为三氧化硫溶于水大量放热,水沸腾形成酸雾,酸雾随着气流离开,减少对三氧化硫的吸收效果)
能被
等强氧化剂氧化生成 二氧化硫不与浓硫酸反应,因为两者如果反应,会归中反应至+5 价,而+5 价的硫化物不稳定
因此,二氧化硫可以用浓硫酸干燥
氧化性
与 反应: > $\ce{H2S}$ 已是最低价态,只能表现还原性,二氧化硫表现氧化性漂白性
具有漂白作用,能使 品红溶液 等有色物质褪色 漂白的原理是
与有色物质结合生成了不稳定的无色物质,与其氧化性无关。加热后又显红色,是由于不稳定的无色物质又分解为原来的 物质 能漂白品红、鲜花等有机色素,不能漂白酸碱指示剂,如酚酞、石蕊等 工业上常用
来漂白纸浆、毛、丝、草帽辫等,还用于消毒、杀菌等
将
通入含酚酞的 溶液中,溶液褪色,与其漂白性无关, 溶于水形成 ,与 中和,使得溶液由碱性变酸性,因此酚酞变色 使溴水、高锰酸钾褪色,与其漂白性无关,是由于其 还原性
- 氯水的漂白原理与
不同,氯水的漂白原理是 与 反应后生成了 具有 强氧化性,将有色的物质氧化为无色的物质,褪色后不能恢复原来的颜色 - 将氯水与
混合,会使得漂白性消失( )
不加热型制备
反应原理:
离子方程式:
一般使用
的浓硫酸, 的浓硫酸氢离子浓度过小;但也不能过小,因为会导致反应速率慢、 过多溶解在水中 加热型制备
(不浓不热不反应) 常考有关阿伏伽德罗常数问题,无法根据
的量判断实际生成的 ,因为浓硫酸浓度随反应降低而停止反应 干燥:使用浓
干燥(两者不反应) 收集:密度比空气大,向上排空气法
尾气处理:
溶液
物理性质:标况下为无色固体,常温下为无色液体,熔点为
, 易升华,极易溶于水并放出大量热 化学性质:
与水反应:
与碱性氧化物反应
与碱反应:
与某些盐溶液反应:
用于鉴别
与 : 加入 溶液中无沉淀
硫酸根离子的检验
原理:在溶液中,
可与 反应,生成 不溶于稀盐酸 的白色 沉淀 强酸根形成的沉淀往往难溶于强酸,例如
、 不溶于盐酸、硝酸 操作方法
取少许待测液于洁净试管中,先加入足量稀盐酸酸化
与 形成沉淀, 与 形成沉淀;稀盐酸可排除 的干扰 上一步后无明显现象(若有沉淀,则静置后取上层清液),滴加
溶液 若有白色沉淀产生,则说明待测液中含有
若无白色沉淀产生,则说明待测液中不含
注意事项
不能只加入
,且盐酸和 的顺序不可以颠倒 例如:待测液先加入
,发现白色沉淀,再加入稀盐酸,观察到沉淀不消失,不可判断是 因为虽然排除了
和 的干扰,但也有可能是 ( 不会使 沉淀消失) 不可以引入硝酸根,例如不可以加
酸化或是加