微粒间作用力与物质性质 · 二 · 「分子间作用力 分子晶体」
分子间作用力
日常生活中,我们经常见到许多由分子聚集成的物质,它们常以液态或固态的形式存在,如汽油、水、冰、干冰等。降温加压时气体会液化降温时液体会凝固,这些事实表明分子之间存在着相互作用力
将分子聚集起来的作用力叫分子间作用力
共价分子间都存在分子间作用力
分子间作用力本质上是一种 静电作用,比化学键弱得多
范德华力 和 氢键 是两种最常见的分子间作用力
范德华力
范德华力的特点
范德华力 很弱,比化学键的键能小
数量级 范德华力一般 没有方向性和饱和性
范德华力主要影响物质的 熔点、沸点、溶解度 等物理性质
影响因素:
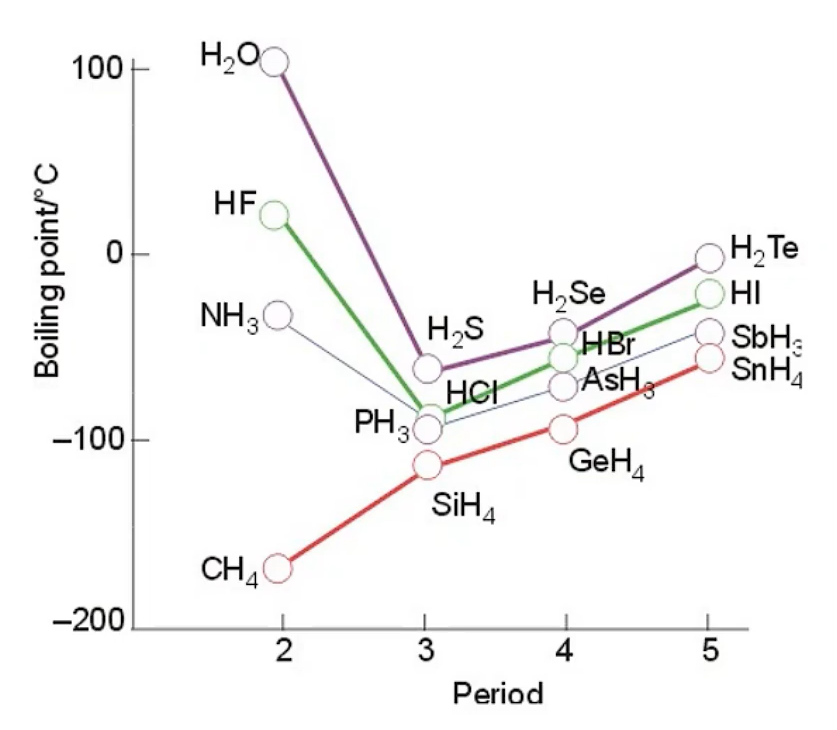
组成和结构相似的分子,其范德华力一般 随着相对分子质量的增大而增大
相对分子质量相近时,分子的极性越大,范德华力一般也越大
对于相对分子质量相同、极性相似的分子,分子之间的接触面积越大,范德华力越大。如范德华力:正丁烷>异丁烷
分子 分子量 范德华力( ) 为什么范德华力:
答:相对分子质量越大,分子间作用力越大
为什么范德华力:
答:分子极性越大,范德华力越大
对物质性质的影响因素
对物质熔、沸点的影响:由分子构成的物质中范德华力越大,物质的熔、沸点越高
对物质溶解性的影响:
液体的互溶以及固态、气态的非电解质在液体里的溶解度都与范德华力有密切的关系。溶剂与溶质分子间作用力越大,溶质的溶解度越大。如
时,氧气在水中的溶解量( )比氮气在水中的溶解量( )大,就是 与水分子之间的作用力比 与水分子之间的作用力大所导致的 怎么解释卤素单质从
的熔点与沸点越来越高 答:组成和结构相似的分子,相对分子质量越大,范德华力越大,熔沸点越高
范德华力主要影响物质的物理性质,而化学键主要影响物质的化学性质
氢键
概念:由已经与电负性很强的原子(如
)形成共价键的氢原子,与另一个分子中电负性很强的原子之间的作用力 表示:通常用
为 等中的一种,「 」表示共价键,「 」表示氢键 特征:比化学键的键能小,但比范德华力强,不属于化学键
存在:
、含氧酸、含氧酸的酸式盐、醇、羧酸、酚等 醛、酮等有机物,虽有
存在,但与 原子直接连接的是电负性较小的 ,故分子之间不能形成氢键
氢键和范德华力共存:
如
的分子之间 既存在范德华力,又存在氢键。因此,把冰融化或把水汽化不仅要破坏范德华力,还必须提供额外的能量破坏分子间氢键,不能认为有氢键就不存在范德华力
特点
方向性
三个原子一般在同一直线上,在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定 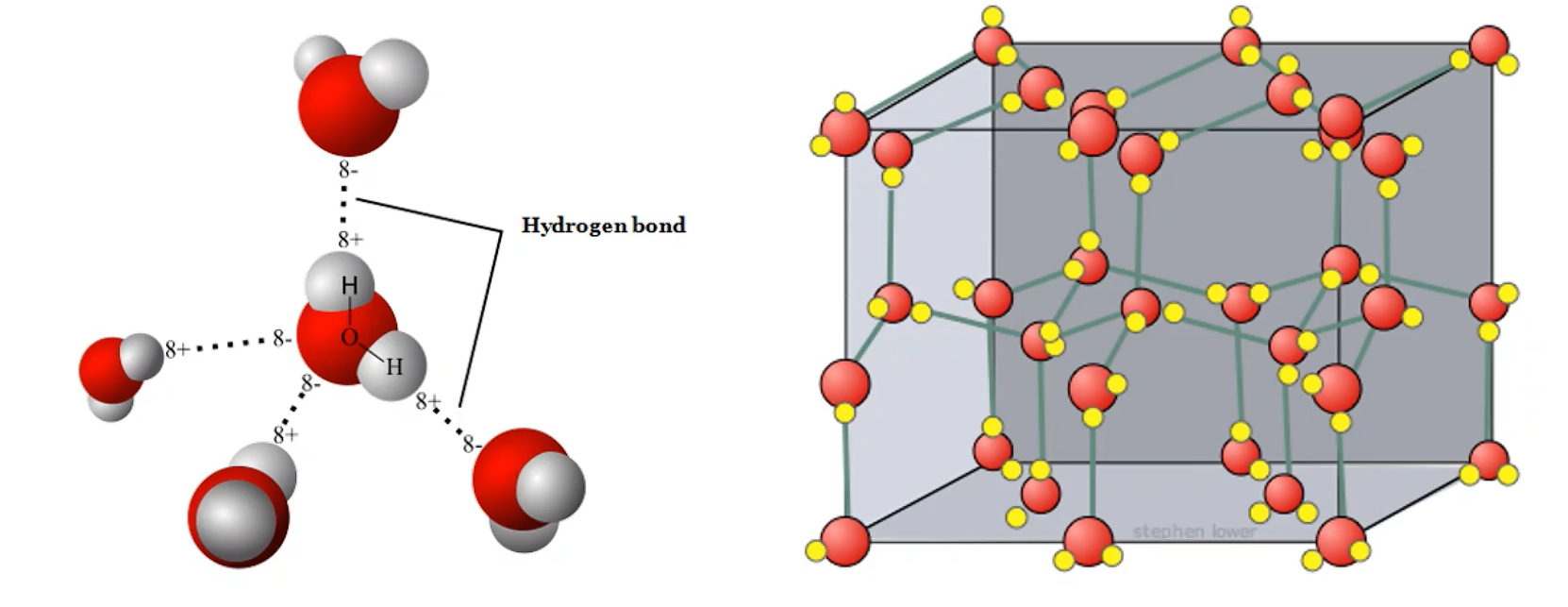
饱和性
每一个
只能与 个 原子形成氢键,这是因为 原子半径很小,若再有一个原子 接近时,则 会受到 原子电子云的排斥 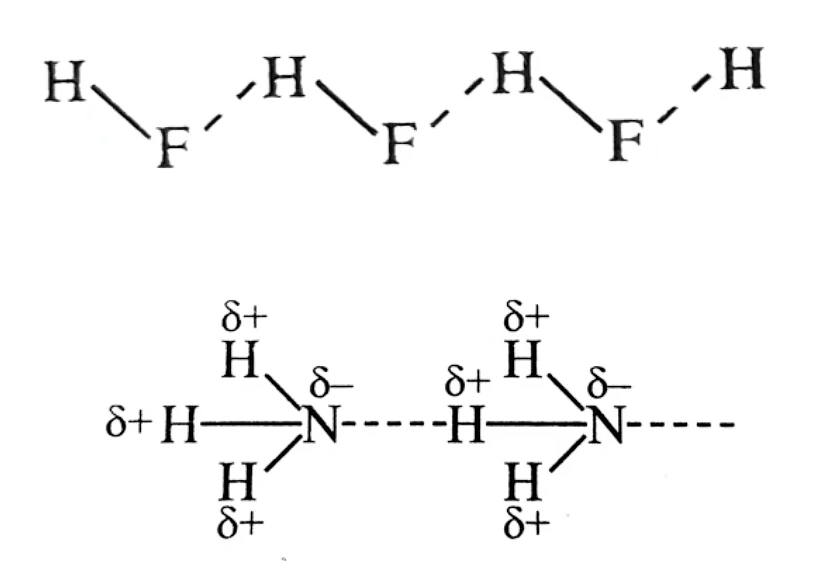
平均
分子 ,只有 个氢键;平均 分子 ,只有 个氢键;平均 分子 ,只有 个氢键
分子内氢键与分子间氢键
邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键。当对羟基苯甲醛熔融时,需要消耗较多的能量克服分子间氢键,所以对羟基苯甲醛的熔点高于邻羟基苯甲醛。邻羟基苯甲酸和对羟基苯甲酸也有类似的现象
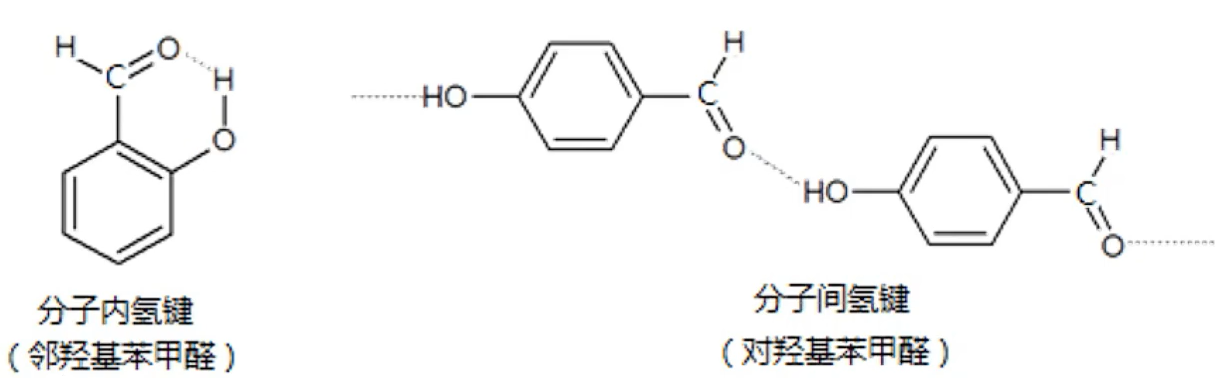
总结:形成分子内氢键会降低物质熔点 (意味着分子间氢键数目减少,熔点降低)
氢键对物质物理性质的作用
含有分子间氢键的物质具有较高的熔点、沸点
形成分子内氢键会降低物质熔点
含有分子间氢键的液体一般黏度比较大
分子间氢键的存在使溶质在水中的 溶解度 比较大
含有分子内氢键的物质具有 较低的熔、沸点
对物质密度的影响:氢键的存在会使某些物质的密度反常,如水的密度比冰的密度大
对相对原子质量测定的影响:例如接近水的沸点的水蒸气的相对分子质量测定值比按化学式
计算出来的相对分子质量大一些,原因是水分子因氢键而相互缔合
分子晶体的概念
概念:只含 分子 的晶体,或者分子间以 分子间作用力 结合形成的晶体
分子晶体中的粒子及粒子间的相互作用
常见的典型分子晶体
所有 非金属氢化物:如
(卤化氢)等 部分 非金属单质:如
(卤素单质)、 、稀有气体等 部分 非金属氧化物:如
等 几乎所有的 酸:如
等 绝大多数 有机物 :如 苯、四氯化碳、乙醇、冰醋酸、蔗糖 等
分子晶体的物理性质
分子晶体熔、沸点较低 ,硬度很小 (多数分子晶体在常温时为气态或液态)
除
、离子液体 外,常温常压下呈气体或液体都是分子晶体 分子晶体不导电
分子晶体的溶解性一般符合「 相似相溶 」规律
与 均为非极性分子,「相似相溶」,可相互溶解 而
不易溶于 (极性分子)
| 堆积类型 | 分子密堆积 | 分子非密堆积 |
|---|---|---|
| 微粒间作用力 | 范徳华力 | 范德华力和氢键 |
| 空间特点 | 通常每个分子周围有 | 每个分子周围紧邻的分子数小于 |
| 举例 |
常见分子晶体的结构分析
分子非密堆积:冰晶体
条件:分子间的主要作用力是氢键
结构:冰晶体中,水分子间主要通过 氢键 形成晶体。由于氢键具有一定的 方向性,一个水分子与周围四个水分子结合,这四个水分子也按照同样的规律再与其他的水分子结合。
这样,每个
原子周围都有四个 原子,其中两个 原子与 原子以共价键结合,另外两个 原子与 原子以氢键结合,使水分子间构成 四面体 骨架结构。其结构可用下图表示 
性质:由于氢键具有方向性,冰晶体中水分子未采取密堆积方式,这种堆积方式使冰晶体中水分子的空间利用率不高,留有相当大的空隙。当冰刚刚融化成液态水时,水分子间的空隙 减小 ,密度反而增大,超过
时,分子间距离 加大 ,密度逐渐减小
分子密堆积:干冰
条件:分子间作用力只有范德华力,无分子间氢键
结构:固态
称为干冰,干冰也是分子晶体。 分子内存在 共价键,分子间存在 范德华力 , 的晶胞呈面心立方体形,立方体的每个顶角有一个 分子,每个面上也有一个 分子。每个 分子与 个 分子等距离相邻(在三个互相垂直的平面上各 个或互相平行的三层上,每层上各 个) 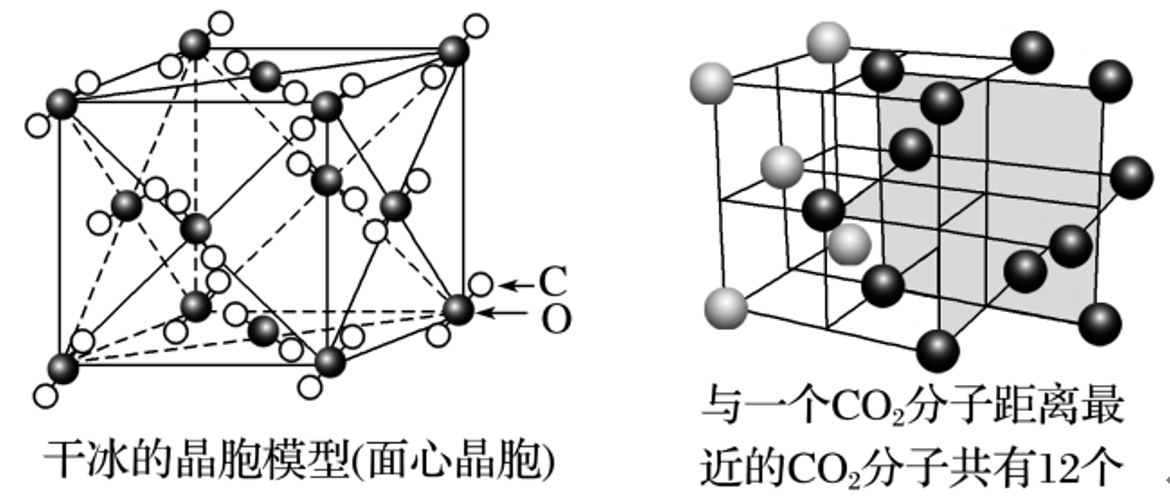
性质:干冰的外观很像冰,硬度也跟冰相似,熔点却比冰低得多,在常压下极易升华,在工业上广泛用作制冷剂;由于干冰中的
之间只存在 范德华力 不存在 氢键 ,密度比 冰 的高。