微粒间作用力与物质性质 · 五 · 「离子键 离子晶体」
离子键
- 概念:带相反电荷离子之间的相互作用称为离子键(ionic bond)。其成键粒子为阴阳离子,相互作用为 静电作用(引力和斥力),成键过程为:阴阳离子接近到某一定距离时, 吸引和排斥达到平衡
- 离子键没有 方向性 和 饱和性,因此,以离子键结合的微粒倾向于形成紧密堆积,使每个离子周围尽可能多地排列带异性电荷的离子,从而达到稳定结构
晶格能
- 概念:离子晶体中阴、阳离子间相互作用力的大小可用晶格能(lattice energy)来衡量。晶格能(符号为
)是指拆开 离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量。例如
- 影响因素:
- 离子的电荷数:离子所带的电荷数越多,晶格能越大
- 离子半径:离子半径越小,晶格能越大
- 与离子晶体性质的关系 晶格能越大,形成的离子晶体更稳定,熔点更高,硬度更大
离子晶体
- 概念:由 阳离子 和 阴离子 相互作用而形成的晶体
- 相互作用力:阴、阳离子间以离子键结合,离子晶体中还可能存在共价键、氢键等
- 常见的离子晶体:强碱、活泼金属的氧化物和过氧化物、大部分的盐
离子晶体相关概念理解时的注意点
- 离子晶体中无分子。如
、 只表示晶体中阴、阳离子的个数比,为化学式,不是分子式 - 由金属元素和非金属元素形成的晶体不一定是离子晶体,如
,是分子晶体;全由非金属元素形成的晶体也可能是离子晶体,如 ,等铵盐的晶体为离子晶体 - 离子晶体中一定存在离子键,除离子键外可能有其他类型的化学键。如
晶体中除有钠离子与氢氧根离子间的离子键外,还有氢氧根离子内氢原子和氧原子间形成的极性共价键 - 离子晶体中,每一个离子周围排列的带相反电荷的离子数目都是固定的,不是任意的
- 对于超导材料,一般暗示为离子晶体
物理性质
熔沸点 离子晶体具有 较高的熔、沸点,难挥发。离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用力使物质熔化或沸腾,就需要较多的能量。因此,离子晶体具有熔、沸点较高和难挥发的性质
注意:
- 离子晶体的熔、沸点和硬度与离子键的强弱有关,离子键越强,离子晶体的 熔、沸点越高,硬度越大
- 离子键的强弱与离子半径和离子所带电荷数有关,离子半径越小,离子所带的 电荷数越多,离子键越强
硬度离子晶体硬而脆。离子晶体中,阴、阳离子间存在较强的离子键,使晶体表现出较大的便度,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎
导电性离子晶体固态时不导电,熔融状态或溶于水后能导电。离子晶体中离子键较强,离子不能自由移动,即晶体中无自由移动的离子,因此固态时不导电。当温度升高时,阴、阳离子获得足够能量,克服了离子间的相互作用,成为自由移动的离子,在外界电场作用下,离子定向移动而导电 离子化合物溶于水时,阴、阳离子受到水分子作用变成了自由移动的离子(或水合离子),在外加电场作用下,阴、阳离子定向移动而导电
溶解性 大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、煤油)。当把离子晶体放在水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的阴、阳离子克服了离子间的相互作用而发生电离,变成在水中自由移动的离子
常见离子晶体的结构
晶胞 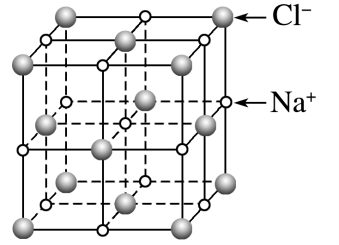
晶胞如图所示,每个 周围距离最近的 有 个,构成正八面体。每个 周围距离最近的 有 个,构成正八面体,由此可推知晶体的化学式为 - 每个
周围距离相等且最近的 是 个 - 每个晶胞中实际拥有的
数是 个, 数是 个 - 若晶胞参数为
,则氯化钠晶体的密度为
- 每个
晶胞 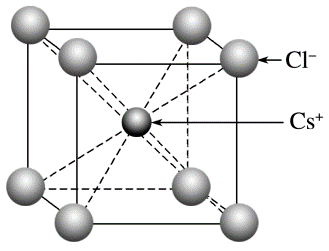
晶胞如图所示,每个 周围距离最近的 有 个,每个 周围距离最近的 有 个,它们均构成正六面体,由此可推知晶体的化学式为 - 每个
周围距离最近的 有 个,构成 正八面体 - 每个晶胞中实际拥有的
有 个, 有 个 - 若晶胞参数为
,则氯化铯晶体的密度为
- 每个
晶胞 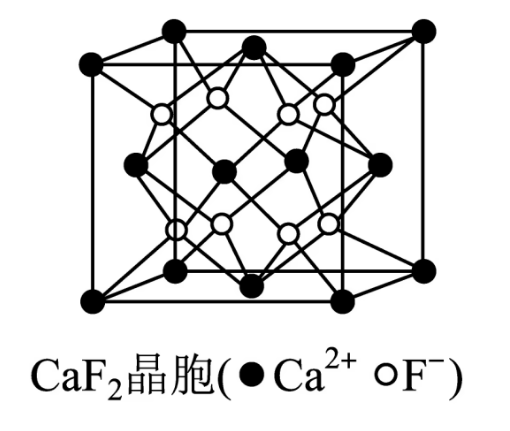
的堆积方式为面心立方堆积, 所处位置为 个小正方体的体心 呈立方密堆积,阴离子 填充在四面体空隙中,位于对角线的 和 处。 离子的配位数分别为 和 - 在一个晶胞中有
个 、 个