有机化学基础 · 一 · 「研究有机化合物的一般方法」
有机化合物的分离、提纯
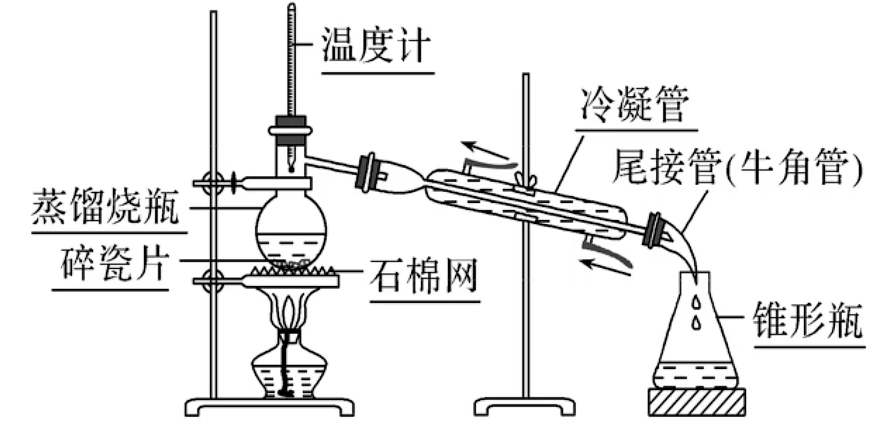
蒸馏
- 蒸馏原理:利用有机物与杂质的沸点差异,将有机化合物以蒸汽的形式蒸出,然后冷凝得到产品
- 适用对象:互相溶解、沸点不同的液态有机混合物
- 适用条件:
- 用于分离互溶的液体混合物
- 有机物的热稳定性较强
- 有机物与杂质的沸点相差较大(一般约大于
)
无水乙醇的制取: 会先加入
(吸水剂) ,直接蒸馏出乙醇
实验装置与注意事项
- 使用 直形冷凝管(不得使用球形冷凝管)(回流直形、球形都可以)
- 使用 锥形瓶(不用烧杯,口径较大,导致液体汽化)
- 蒸馏烧瓶里盛液体的用量不超
,不少于 - 加入沸石或碎瓷片,防止暴沸,若忘记加沸石,应停止加热,待冷却之后再补加
- 温度计水银球应与蒸馏烧瓶的支管口平齐
- 冷凝水应 下口进入,上口流出,与蒸汽流向相反,以充分冷凝
- 蒸馏烧瓶需要垫石棉网加热
- 实验开始时,先通冷凝水,后加热;实验结束时,先停止加热,后停止通冷凝水
萃取
原理:
- 液
液萃取:利用待分离组分在两种不互溶的溶剂中的 溶解性不同,使待分离组分从 溶解度较小 的溶剂中转移到 溶解度较大 的溶剂中 - 固
液萃取:用溶剂从固体物质中溶解出待分离组分
- 液
萃取剂:
- 选择原则:
- 与原溶剂 互不相溶
- 与溶质、原溶剂均不反应
- 溶质在萃取剂中的溶解度远大于原溶剂
- 常用萃取剂:乙醚(
)、乙酸乙酯、二氯甲烷等
- 选择原则:
检漏:
- 关闭下方活塞,加入适量蒸馏水,静置,如没有水流下,说明活塞处不漏水
- 塞上上方玻璃塞,倒置,如没有水流出,将分夜漏斗正立,把玻璃塞旋转
,再倒置,如仍没有水流出,说明玻璃塞处不漏水
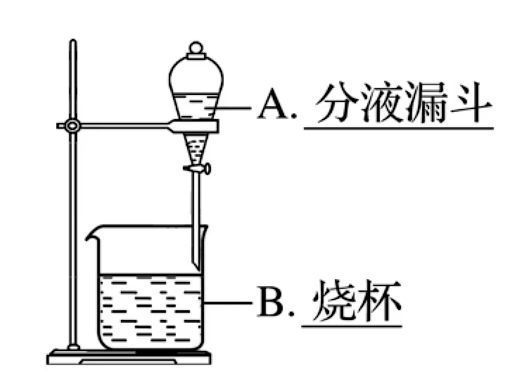
主要仪器:分液漏斗
实验装置与注意事项 操作步骤:检漏
加试剂振荡 静置分层 分液 分液漏斗使用之前必须检漏
使用时需将漏斗上口的玻璃塞打开,或使玻璃塞上的凹槽对准分液漏斗上的小孔
漏斗下端管口紧靠烧怀内壁,分液时 下层液体从下口流出,上层液体从上口倒出
举例:
用苯萃取溴水中的溴:溴水橙(红)色,苯无色,萃取后,苯密度小于水,溴的苯溶液处于上层橙(红)色,下层为水无色
用苯萃取碘水中的碘:碘水为棕黄色,萃取后,碘的苯溶液在上层紫红色,水在下层无色
用四氯化碳萃取溴水中的溴:萃取后,四氯化碳的密度大于水,溴的四氯化碳溶液处于下层橙(红)色,水在上层无色
用四氯化碳萃取碘水中的碘:萃取后,碘的四氯化碳溶液在下层紫红色,水在上层无色
重结晶
原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去
适用对象:固体有机化合物
溶剂选择:要求杂质在此溶剂中溶解度很小或溶解度很大,易于除去;被提纯的有机化合物在此溶剂中的溶解度受温度的影响较大,能够进行冷却结晶
操作步骤
使用重结晶法分离固体化合物时,根据杂质的溶解度不同,应选择不同的操作步骤
杂质的溶解度很小:加热溶解
趁热过滤(滤去部分杂质,目标产物在溶液中) 冷却结晶 杂质的溶解度很大:加热溶解
蒸发浓缩 冷却结晶(杂质在溶液中,目标产物结晶析出)
注意
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度
若第一步「加热溶解」得到的是饱和溶液,过滤时会因溶液的温度降低而析出一部分溶质,造成损失,所以通常再加入少量蒸馏水,减少趁热过滤过程中的损失
以重结晶法提纯苯甲酸为例
实验目的:提纯含有少量氯化钠和泥沙杂质的苯甲酸
资料:纯净的苯甲酸为无色结晶,其结构可表示为
熔点
,沸点 。苯甲酸 微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下:
温度 溶解度 实验操作:
趁热过滤:避免甲酸因降温析出,影响产率
除杂实验
| 有机物(杂质) | 除杂方式 |
|---|---|
| 加入饱和碳酸氢钠溶液 | |
| 苯(苯酚) | 加入氢氧化钠溶液,分液 |
| 先加氧化钙(不必过滤),然后蒸馏 | |
| 通入高锰酸钾溶液,然后通过碱石灰 | |
| 苯( | 先加氢氧化钠溶液,然后分液 |
| 乙炔(硫化氢、磷化氢) | 通过硫酸铜溶液 |
| 乙烯(二氧化硫) | 通过碱石灰或加入氢氧化钠溶液 |
乙醇溶于水;乙酸与碳酸氢钠反应,并降低乙酸乙酯的溶解度,分液后在上层
;苯酚钠不溶于苯
作吸水剂;蒸馏以除去甲醇
由于甲烷可溶于四氯化碳因此不能用溴的四氯化碳溶液来除去乙烯,但是可以使用溴水
, 可溶于水
气体杂质不得使用气体除杂
实验设计
| 实验目标 | 实验设计 |
|---|---|
| 检测溴乙烷中的溴 | 加入 再加入 |
| 粗苯甲酸的提纯 | 重结晶(具体步骤:加热溶解,趁热过滤,冷却结晶) |
| 检验淀粉是否水解完全 | 加入碘液,观察颜色,溶液出现蓝色 |
| 检验溴乙烷发生消去反应生成的乙烯 | 先通过水除杂,然后通过酸性溶液 (或通过 |
| 鉴别甲烷、乙烯和乙炔 | 分别点燃,观察黑烟的浓度和火焰的亮度 |
| 乙烯的实验室制取 | 利用乙醇的消去反应 |
| 工业制备乙烯 | 石油裂解 |
有机化合物的组成、结构、反应的研究
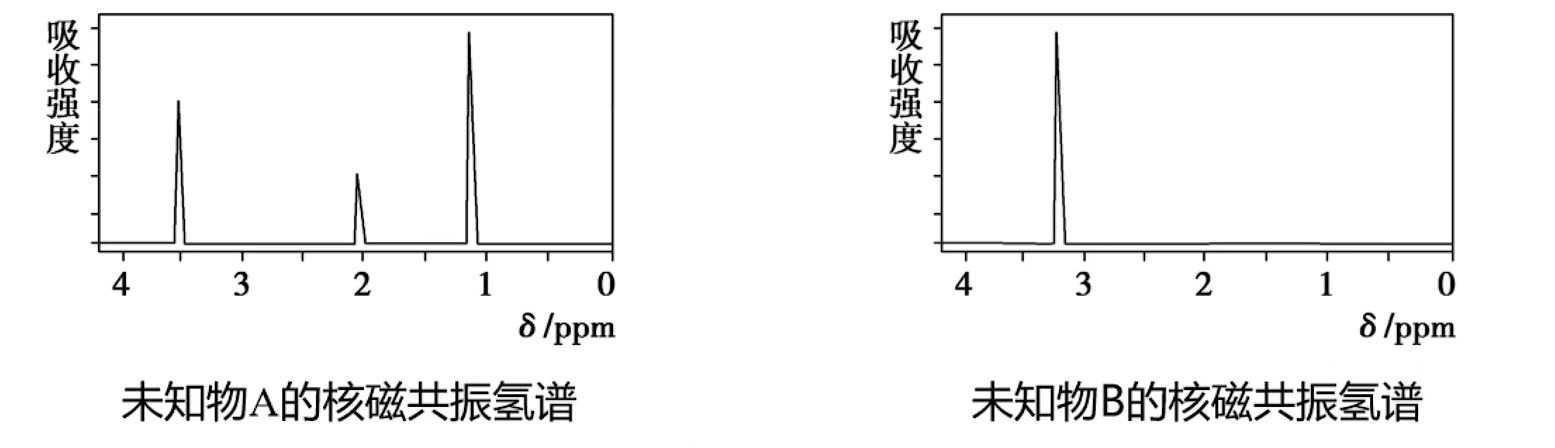
核磁共振氢谱
- 应用:测定有机化合物分子中有几种不同类型的氢原子及它们的相对数目
- 原理:氢原子核具有磁性,如用电磁波照射含氢元素的化合物,其中的氢核会吸收特定频率电磁波的能量而产生核磁共振现象。用核磁共振仪可以记录到有关信号,处在不同化学环境中的氢原子因产生共振时吸收电磁波的频率不同,相应的信号在谱图中出现的位置也不同,具有不同的化学位移(用
表示),而且吸收峰的面积与氢原子数成正比 - 关系:吸收峰数目
氢原子种类数,吸收峰面积比 不同种类的氢原子个数比
乙醇和二甲醚的核磁共振氢谱
(乙醇)分子中有 种处于不同化学环境的氢原子,对应的核磁共振氢谱图中只有 个峰,强度比为 (二甲醚)分子中的 个氢原子的化学环境相同,对应的核磁共振氢谱图中只有一个峰
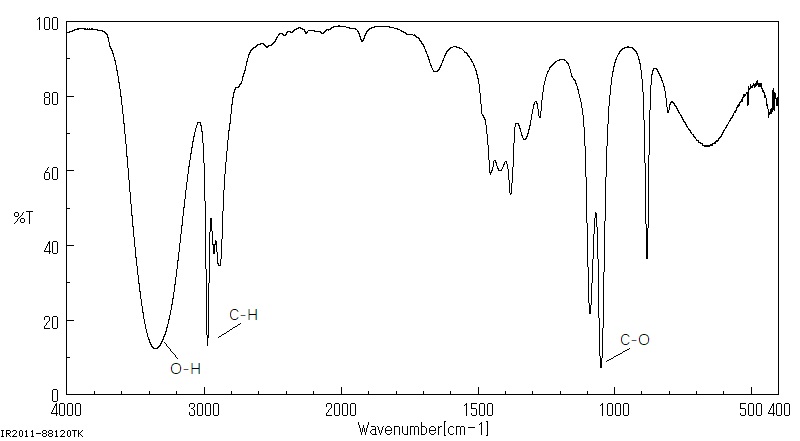
红外光谱法
- 作用:初步判断某有机物分子中所含有的 化学键 或 官能团
- 原理:不同的化学键或官能团的吸收频率不同,在红外光谱图上将处于不同的位置
例如:分子式为 C, H, O 的红外光谱上发现有
、 和 的吸收峰,可推知该分子的结构简式为
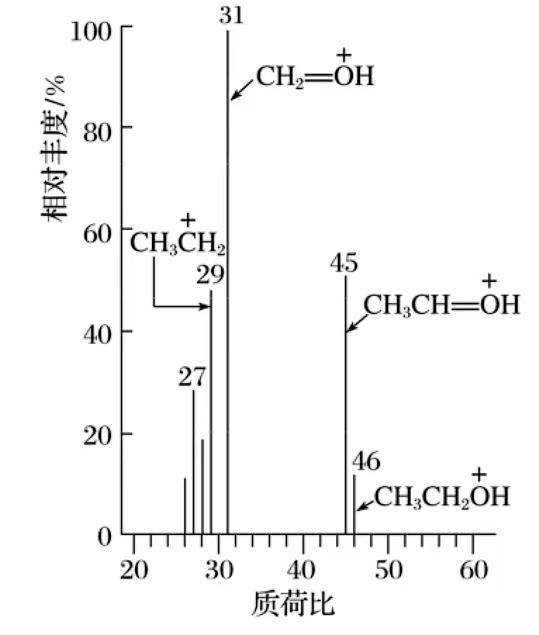
质谱法
- 原理:用高能电子流等轰击样品,使有机分子失去电子,形成带正电荷的分子离子和碎片离子等,带正电荷的分子离子和碎片离子质量不同、电荷不同,因此它们在电场和磁场中的运动行为不同。它们在磁场的作用下到达检测器的时间不同,通过计算机分析得到质荷比,以质荷比为横坐标,以各类离子的相对丰度为纵坐标记录结果,得到质谱图
- 质荷比:质荷比是指分子离子或碎片离子的相对质量与其电荷效的比值。在有机化合物的质谱图中,质荷比的最大值等于该有机化合物的相对分子质量
- 注意
- 质荷比的最大值对应的相对丰度不一定最大
- 互为同分异构体的两种分子的质谱图中,虽然二者质荷比最大值相同但是质谱图并非完全相同
如图所示为未知物
的质谱图,质荷比最大值为 ,表示未知物 的相对分子质量为
- 原理:
射线是一种波长很短( 约 )的电磁波,它和晶体中的原子相互作用可以产生衍射图。经过计算可以从中获得分子结构的有关数据,包括键长、键角等分子结构信息 - 应用:将
射线衍射技术用于有机化合物(特别是复杂的生物大分子)晶体结构的测定,可以获得更为直接而详尽的结构信息
总结
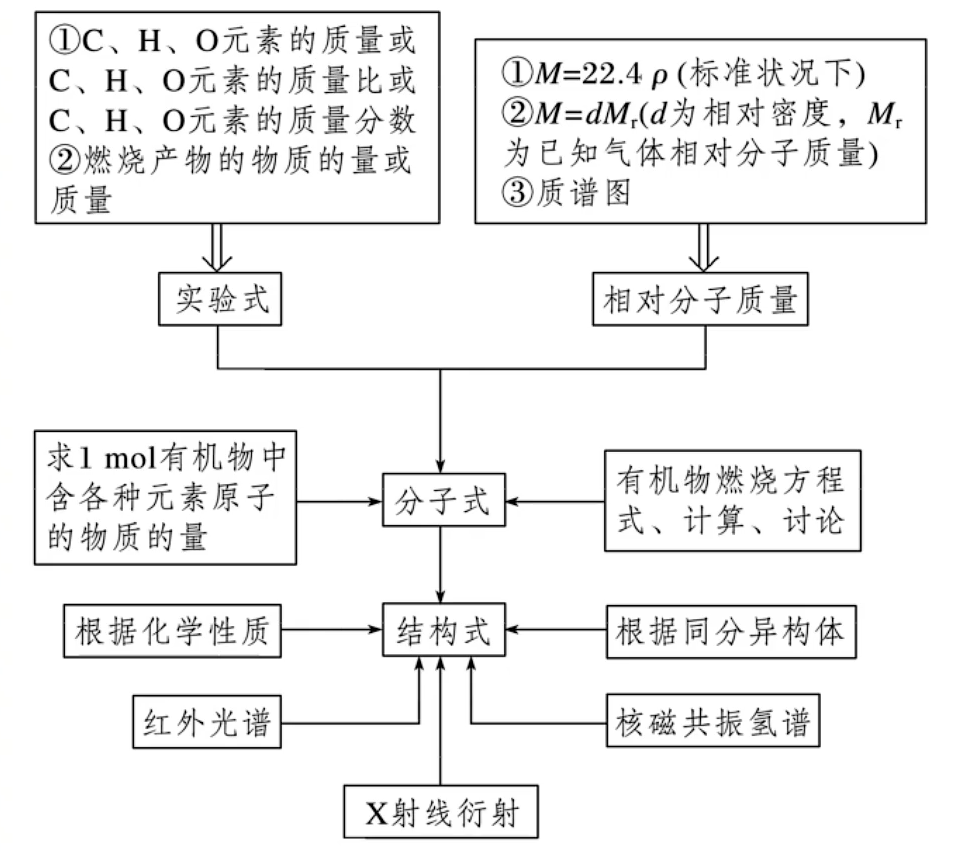
谱图法在确定有机物分子结构中的应用:
- 核磁共振氢谱图:各类氢原子个数之比
- 红外光谱图:推知有机物分子中含有的 化学键、官能团
- 质谱图:质荷比的最大值等于该有机化合物的 相对分子质量
射线衍射技术:用于有机化合物(特别是复杂的生物大分子)晶体结构的测定