元素及其化合物 · 六 · 「氯
氯
氯气
物理性质
黄绿色 气体,有刺激性气味,可溶于水(1体积的水溶解约2体积的氯气),密度大于空气,沸点比气体高,易液化,有毒
闻氯气气味的方法:抽去盛氯气的集气瓶口处的毛玻璃片,用手掌在瓶口上方轻轻扇动,使少量氯气飘进鼻孔
化学性质
氯气与氢气反应:
实验操作:在空气中点燃氢气(点燃前要验纯),然后把导管伸入盛有氯气的集气瓶中。
实验现象:氢气在氯气中安静地燃烧,发出苍白色的火焰,瓶口出现白雾
工业制
时采用点燃法,工业浓 常显黄色,是因为含 氯气与金属单质反应
与铁反应:
反应现象:产生黄色火焰,棕褐色烟雾
与反应物的量无关(
只发生在氯化铁溶液中) 氧化性从高到低排列为:
> > 与 反应生成 与 反应可以生成 与 反应生成
与铜反应:
反应现象:产生棕黄色烟
与纳反应:
反应现象:产生大量白烟
氯气与水反应:
注意:该反应为可逆反应,且由于
为弱酸,离子反应中不可拆 氯气与碱反应
与常温下的 溶液 应用:
实验室吸收多余的
工业制漂白液、84 消毒液,有效成分为
与冷的石灰乳 如果书写离子方程式,
不要拆开,其是以悬浊液存在的 是漂白粉、漂白精的有效成分 起效:
失效:
氯气与还原性无机化合物反应
(除去 中的 ) (氧化性: > ) (用于海水提取溴) (用于用 淀粉试纸检验 ) (失去漂白作用) (用浓氨水检查氯气管道是否漏气)
实验室制备
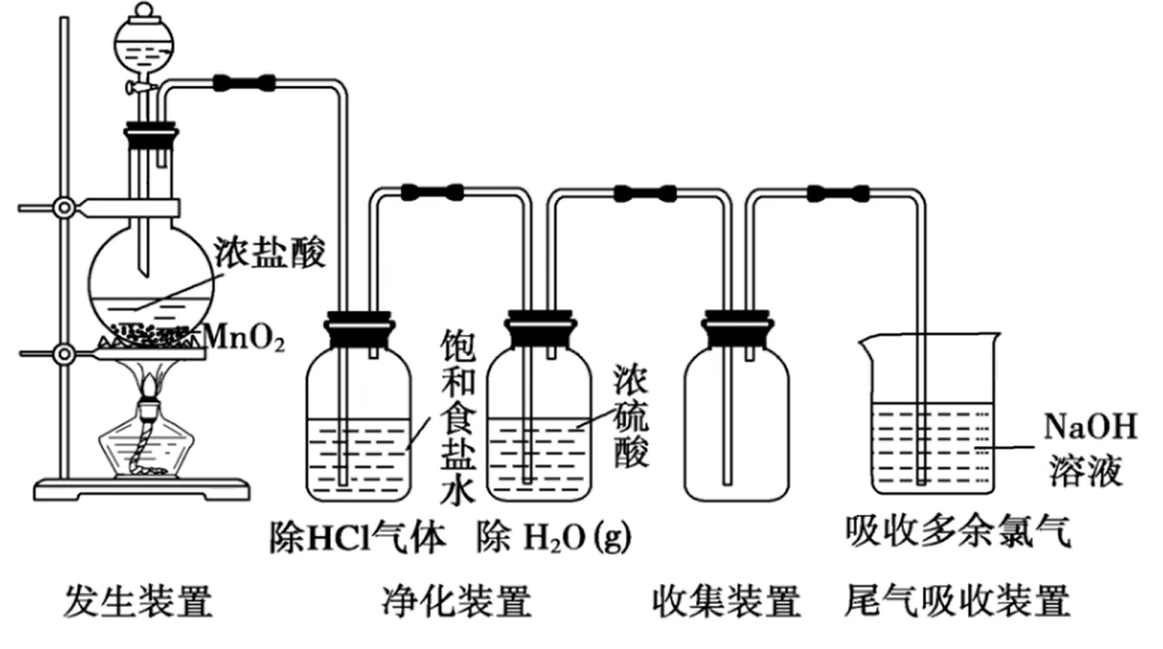
原理:
(不浓不热不反应) 装置:
分液漏斗:固液加热生成气体所需,用于调节浓盐酸滴入速率
饱和食盐水:降低
对水的溶解性,减少损耗( ,氯化钠促进平衡逆移);用于除 气体(氯化氢极易溶于水) 浓硫酸:用于除
蒸汽 向上排空气法:氯气密度比空气大(或排饱和食盐水法)
水溶液:
验满:将湿润的
淀粉试纸靠近瓶口,若试纸立即变蓝,则证明氯气已经收集满
其他制备方法:
- 直接将酸性高锰酸钾溶液加入盐酸中制备,无需加热,无需浓盐酸 反应原理:
- 84 消毒液与洁厕灵混用:
氯水
新制氯水
新制氯水的成分(由大到小)
分子:
离子:
性质
成分 表现性质 实例 黄绿色
强氧化性
弱酸性 与镁反应放出
与反应放出 弱酸性
强氧化性1. 漂白、杀菌、消毒
2.使湿润的有色布条褪色,不能使干燥的有色布条褪色,说明 没有漂白性,而是 起漂白作用
3. 使紫色石蕊试剂先变红(酸性作用),后褪色( 氧化性作用) 沉淀反应
旧置氯水
反应方程式:
成分:
水溶液 性质:有酸性(比新制氯水强),无氧化性、无漂白性
实验室中氯水需 现用现配,且避光、密封保存在 棕色试剂瓶 中
液氯、新制氯水、旧置氯水的比较
液氯 新制氯水 久置氯水 分类 纯净物 混合物 混合物 颜色 黄绿色 浅黄绿色 无色 性质 氧化性 酸性、氧化性、漂白性 酸性 粒子种类 保存 钢瓶 棕色试剂瓶
氯离子的检验
借助
沉淀来检验氯离子的存在,但需要排除碳酸根离子的干扰
实验过程:在三支试管中分别加入 2~3mL 稀盐酸、
溶液、 溶液,然后各滴入几滴 溶液,观察现象。再分别加入少量稀硝酸,观察现象 实验现象:
物质 加入 溶液后 加入稀硝酸后 解释或离子方程式 稀盐酸 白色沉淀( ) 不溶解 溶液 白色沉淀( ) 不溶解 溶液 白色沉淀( ) 溶解并产生气泡 结论:
待测液
(排除 的干扰) 白色沉淀
卤族元素
相似性
都能与大多数金属反应:
都能与
反应: 都能与水反应:
都能与碱液反应:
递变性
颜色:
熔沸点:
密度:
水溶性:
氧化性:
还原性:
比较氧化性的方法:
与氢气化合难易程度;
氢化物的稳定性;
最高价氧化物对应水化物的酸性;
置换反应
特殊性
氟
氟没有正价,是非金属性最强,
的还原性最弱 与 反应生成 和 , 与 在暗处即可爆炸反应 是弱酸,能腐蚀玻璃,应保存在铅制器皿或塑料瓶中;有毒;在卤素氢化物中, 的沸点最高(分子间存在氢键)
溴
是深红棕色液体,易挥发 易溶于有机溶剂 盛放液态溴时,试剂瓶需加水封,保存时不能用橡胶塞封口
碘
遇淀粉变蓝色 加热时易升华(用于分离提纯 ) 易溶于有机溶剂 食盐中添加
可预防和治疗甲状腺肿大
卤素离子的检验
溶液——沉淀法 未知液
置换——萃取法
未知液
氧化——淀粉法检验
未知液(无色)
蓝色溶液
海水资源的开发和利用
海水淡化:蒸馏法、电渗析法、离子交换法
海水制盐:氯碱工业
海水提溴
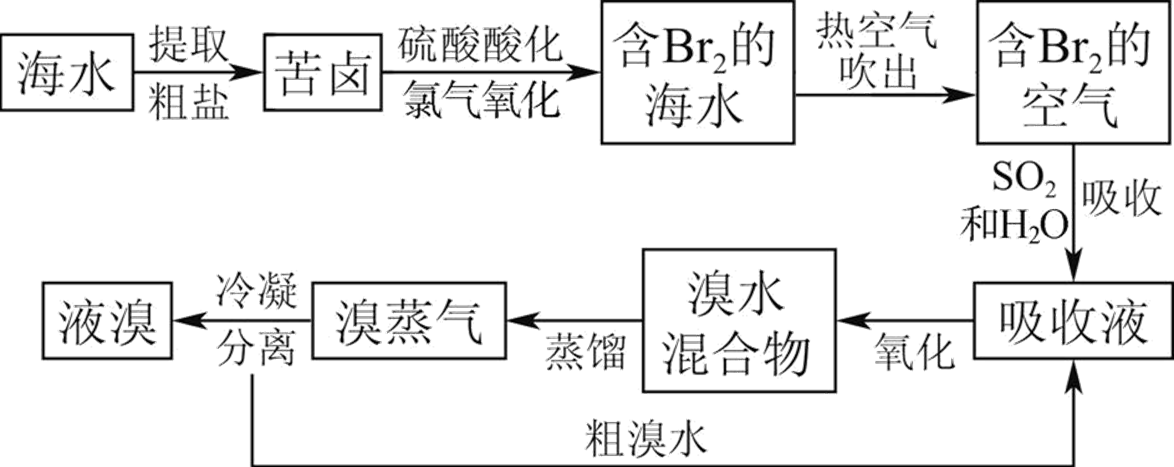
海水提碘
