元素及其化合物 · 九 · 「硅
单晶硅
- 单晶硅的结构与金刚石的相似,为正四面体的立体网状结构。晶体中每个
原子与其他 个 原子相连接 - 单晶硅是带有金属光泽的灰黑色固体,熔点高、硬度大、有脆性,在常温下化学性质不活泼
- 单晶硅的导电性介于导体和绝缘体之间,是良好的半导体材料
化学性质
与非金属单质反应
与 都可以和 反应生成 ,而且前者是非金属,后者是金属。在元素推断题中常出现
与水反应
- 野外制氢:
- 野外制氢:
二氧化硅
结构
杂化方式:
杂化 在
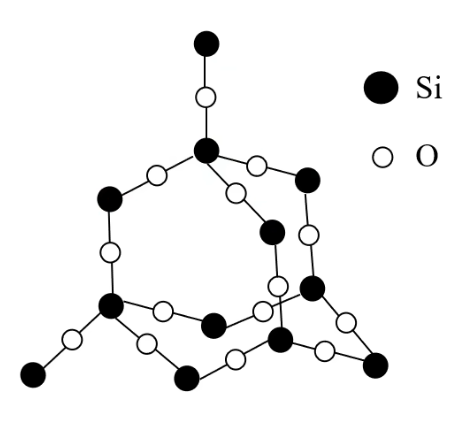
晶体中,每个硅原子均与 个氧原子结合;每个氧原子与 个硅原子结合 在
晶体中硅原子与氧原子个数之比是 在
晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键 在
晶体中,最小环为十二元环,有 个硅原子和 个氧原子 硅原子个数与
共价键个数之是 ;氧原子个数与 共价键个数之比是 晶体中并不存在 分子
物理性质
- 硬度大、熔沸点高、常温下为固体、难溶于水、不导电
化学性质
是一种酸性氧化物 - 与强碱反应:
- 与碱性盐反应
(制作玻璃) (造渣反应)
- 与碳反应
- 精炼
(自然)
- 与强碱反应:
硅酸
白色胶状沉淀
弱酸性
不使酸碱指示剂变色,酸性小于碳酸
不稳定性
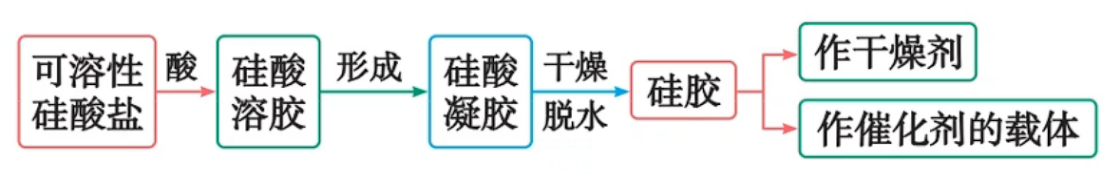
硅酸浓度大时在水中易聚合形成透明、胶冻状的硅酸凝胶,硅酸凝胶经干燥脱水后得到多孔的硅酸干凝胶,成为“硅胶”
硅胶是多孔状,吸附水分子能力强,常用作(食品级)干燥剂,或作催化剂的载体
向硅酸盐溶液中加入盐酸或通入
,可制得硅酸胶体(凝胶)或沉淀 制备硅酸的原理是“强酸制弱酸”,这一原理可用来设计酸性强弱比较的实验,如:证明盐酸 > 碳酸 > 硅酸
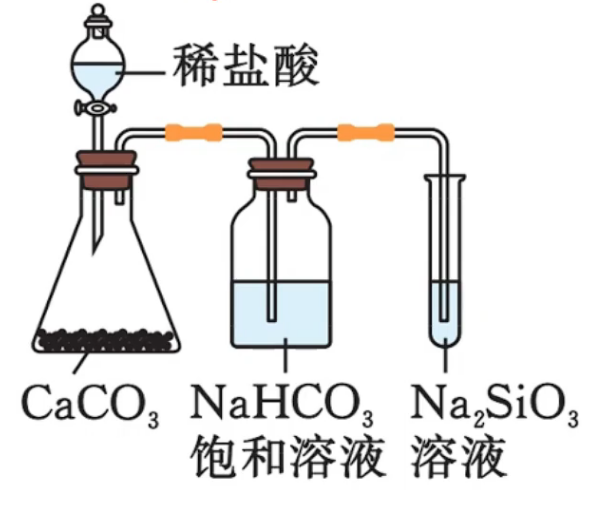
证明酸性:盐酸 > 碳酸 饱和溶液用于除去 中的 ,防止其挥发而干扰实验 证明酸性:碳酸 > 硅酸 - 注意:该实验不能用于验证非金属性
,用于其要用最高价氧化物对应的水化物的酸性强弱来比较
硅酸钠
最简单的硅酸盐
- 白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,是一种矿物胶,有很强的粘合性(所以装
溶液不用玻璃塞) - 可以与酸(盐酸、碳酸等)反应,生成硅酸凝胶
- 用途:制备硅胶,作木材、纺织品的防腐剂、防火剂