化学实验 · 三 · 「常见实验」
制备
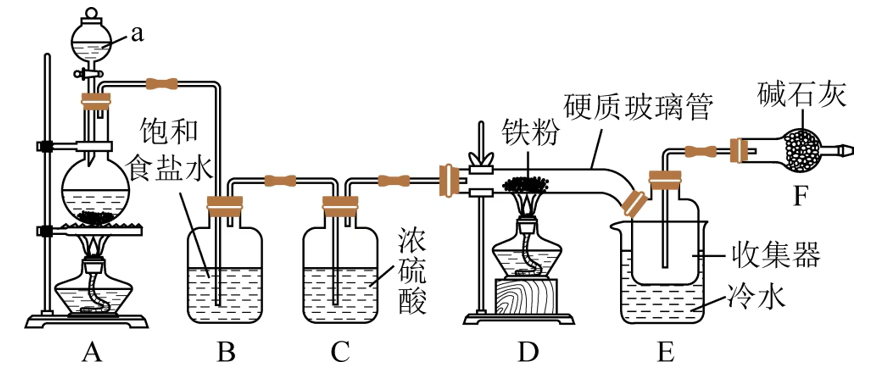
A:
B(饱和食盐水):吸收氯化氢气体
C(浓硫酸):除去氯气中的水分
F(碱石灰):Ⅰ尾气吸收;Ⅱ防止外界水蒸气进入
E:
水解程度较大( ),因此要注意不能使外界水蒸气进入,同时如果要制备 溶液时,应先将 固体溶于少量盐酸(使反应逆向移动),再加水稀释
制备
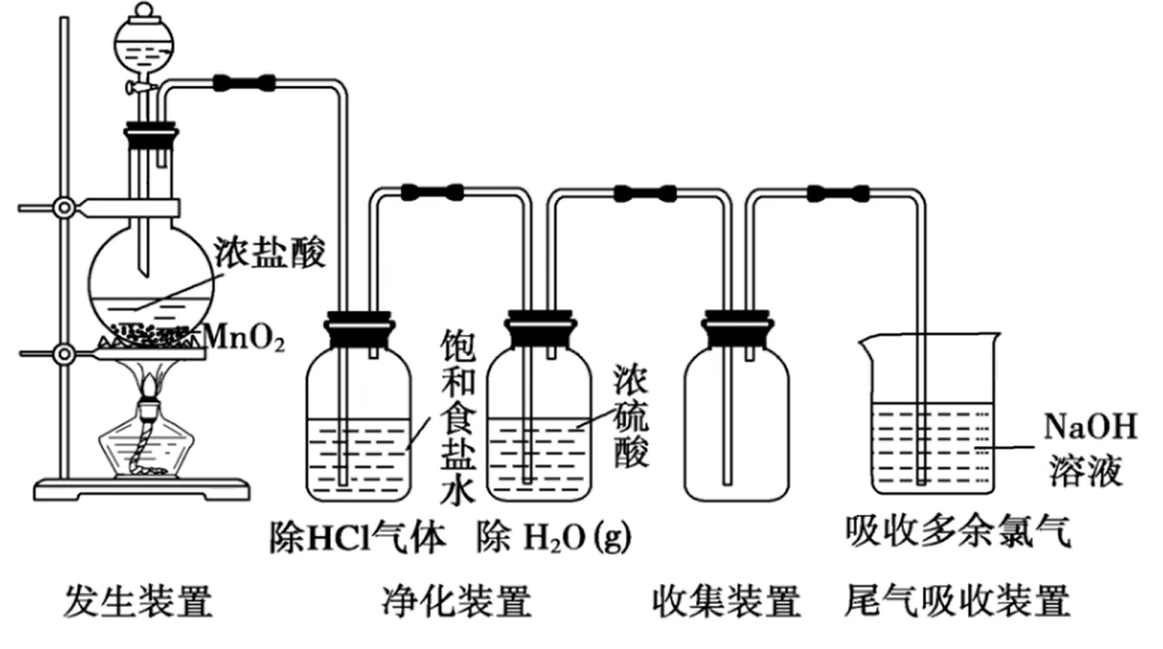
- 原理:
(不浓不热不反应) - 装置:
- 分液漏斗:固液加热生成气体所需,用于调节浓盐酸滴入速率
- 饱和食盐水:降低
对水的溶解性,减少损耗( ,氯化钠促进平衡逆移);用于除 气体(氯化氢极易溶于水) - 浓硫酸:用于除
蒸汽 - 向上排空气法:氯气密度比空气大(或排饱和食盐水法)
水溶液:
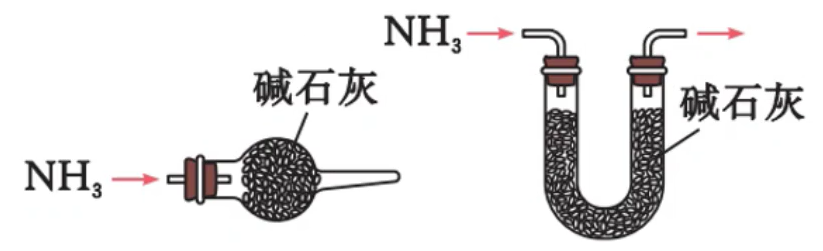
- 验满:将湿润的
淀粉试纸靠近瓶口,若试纸立即变蓝,则证明氯气已经收集满
制备
原理:
收集方法:向下排空气法(导管伸入,接近试管底部)
验满方法:将湿润的红色石蕊试纸放在管口(或 将沾有浓盐酸的玻璃棒靠近瓶口,有白烟生成)
棉花(用水或稀硫酸浸湿)的作用:防止
试管口略向下倾斜,防止产生的水蒸气冷凝回流炸裂试管

不使用
与 共热来制备,因为 碱性过强,在加热条件下易腐蚀玻璃(玻璃耐酸不耐碱) 不得直接加热
来制备氨气,因为生成的 和 在瓶口遇冷重新化合为 使用碱石灰来干燥氨气,不能用浓硫酸、
、无水 作干燥剂( 与 反应生成 )
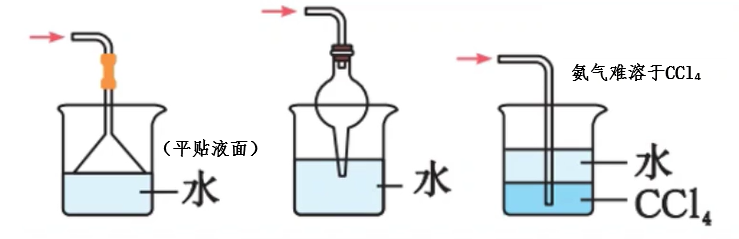
- 要防止倒吸